
细胞自噬(巨自噬)是一种重要的细胞生物学过程,通过吞噬和降解细胞内老化、受损或异常的细胞器和蛋白质来使细胞得到更新和修复,在维持细胞稳态、营养代谢和细胞器质量控制等过程中起着关键作用。目前细胞自噬可以分为自噬体的生成、自噬体与溶酶体融合、自噬体成分循环、底物降解及自噬性溶酶体再生等多个阶段。
ULK激酶复合体作为自噬起始阶段关键的激酶复合体,大量研究表明其通过磷酸化下游底物(例如PI3KC3复合体中的亚基)来启动自噬体的生成。但是目前尚不清楚ULK的激酶活性是否也在自噬的后期发挥调控作用。
2023年6月30日,太阳成集团tyc122cc荣岳光课题组在Journal of Cell Biology期刊上发表了文章“ULK phosphorylation of STX17 controls autophagosome maturation via FLNA”。该研究首次证明ULK通过特异性磷酸化STX17调控其转位到自噬体,进而调控自噬体-溶酶体的融合。此外,微丝结合蛋白FLNA通过与磷酸化的STX17相互作用介导STX17向自噬体的转位,且该功能不依赖FLNA的微丝结合功能(图1)。该研究揭示了自噬早期的关键激酶ULK在自噬后期的新功能。
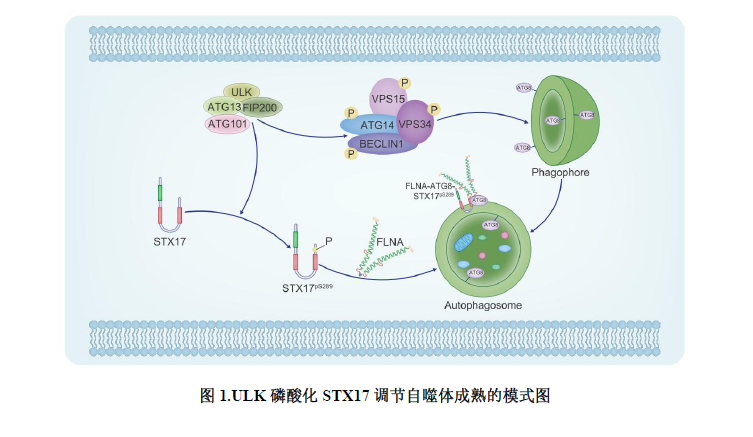
为了探究ULK的激酶活性是否参与自噬体与溶酶体融合的过程,该团队首先研究了ULK是否能够磷酸化介导自噬体-溶酶体融合的SNARE复合体(STX17-SNAP29-VAMP8)。研究发现ULK能特异性改变STX17而不是SNAP29和VAMP8的电泳迁移率。体内和体外的磷酸化以及去磷酸化实验证明STX17电泳迁移率的改变是由ULK对其磷酸化导致。这些结果提示ULK的激酶活性可能调控自噬体与溶酶体的融合。
随后该团队通过质谱鉴定了STX17上9个被ULK磷酸化的位点。进一步研究显示STX17 S289位点的去磷酸化显著抑制了STX17在自噬体上的定位,而STX17 S289位点的磷酸化能促进其在自噬体上的定位。这一结果说明STX17 S289位点的磷酸化状态影响了STX17在自噬体上的定位。为了对该位点的磷酸化进行深入研究,该团队制备了特异性识别STX17 pS289的抗体。利用该抗体研究发现,EBSS饥饿会促进STX17 S289位点的磷酸化,并且STX17 pS289特异性地定位于成熟自噬体,而不是内质网和线粒体。此外,体外磷酸化实验结果显示ULK能够直接磷酸化STX17 S289位点。并且ULK对STX17 S289位点的磷酸化不依赖于自噬体的形成,但自噬体的生成会促进STX17 S289位点的磷酸化。另外,自噬流和RFP-GFP-LC3实验结果显示STX17在S289位点的去磷酸化可以显著抑制自噬活性。
该团队还通过质谱鉴定了STX17的相互作用蛋白FLNA。在缺失FLNA的细胞中,STX17不能转位到自噬体上。进一步研究FLNA调控STX17转位到自噬体的机制,发现FLNA通过3个LIR基序与自噬体上的ATG8相互作用被招募到自噬体外膜。进而自噬体外膜上的FLNA与STX17pS289相互作用促进了STX17转位到自噬体。以上结果说明FLNA很可能作为STX17与ATG8之间的连接蛋白,介导STX17转位到自噬体上。FLNA的突变与脑室周围结节性异位和额颌骨发育不良等疾病密切相关。该团队发现有些突变位于FLNA与ATG8或STX17结合的区域,这些突变破坏了FLNA与ATG8或STX17的相互作用,并且抑制了STX17转位到自噬体以及随后的自噬体-溶酶体融合。
综上所述,该团队不仅揭示了ULK的激酶活性在自噬体成熟过程中的作用,扩展了FLNA不依赖微丝的新功能,而且提示细胞自噬可能与脑室周围结节性异位和额颌骨发育不良等疾病的某些病理表现相关。
太阳成集团tyc122cc博士研究生王玉芬为该论文的第一作者,荣岳光教授为该论文的通讯作者。
原文链接:https://doi.org/10.1083/jcb.202211025
 学院官方微信
学院官方微信